
《中国新药与临床杂志》

健康时报记者根据国家药监局官网(NMPA)不完全统计发现, 2020年共批准了49款新药上市,其中,国产新药20个,进口新药29个,囊括了多款本土重磅肿瘤药物、罕见病药物、“全球首个”药物。
其中,2020年获批的49个新药中,有14个通过医保谈判纳入了2020年国家医保目录,占28%,不足三分之一。
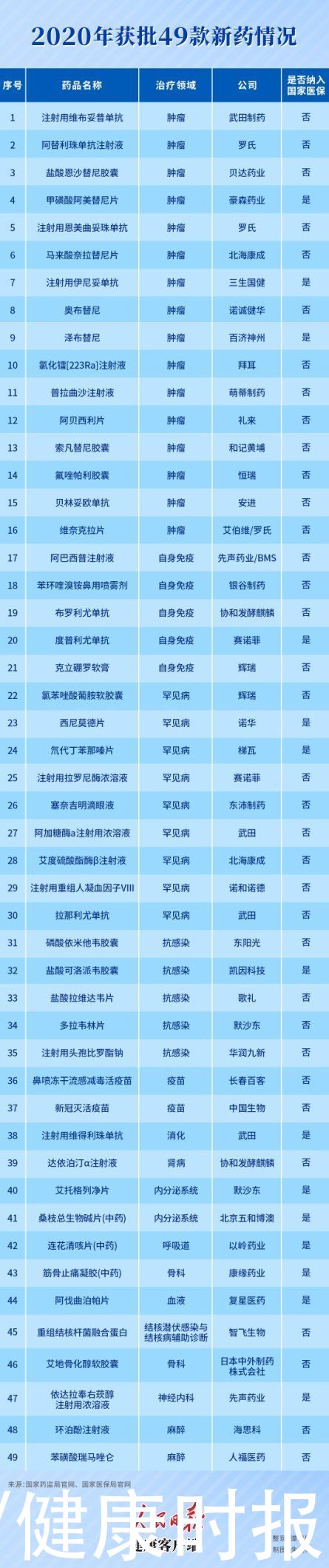
从获批产品治疗领域来看,肿瘤和罕见病是产品获批数量最多的两大领域。
在肿瘤领域,2020年的中国市场收获了几款意义重大的药物。2020年1月,中国首次迎来了抗体偶联药物(ADC)恩美曲妥珠单抗,4个月后,NMPA批准了第二款ADC维布妥昔单抗,这意味着ADC这种创新疗法已在中国实现落地,同样在2020第一次落地的创新疗法还有艾伯维/罗氏的BCL-2抑制剂维奈克拉片以及安进的双抗药物贝林妥欧单抗。
在罕见病领域,相较2019年获批的新药数量翻了近一倍,共有9款产品获批。治疗多发性硬化症的西尼莫德片、治疗黏多糖贮积症I型的拉罗尼酶浓溶液和治疗亨特综合征的艾度硫酸酯酶β注射液等均填补了中国相关疾病治疗领域无药可用的空白。
2020年获批的新药很多都出现在临床急需的名单中,如注射用维得利珠单抗、氯苯唑酸葡胺软胶囊、注射用拉罗尼酶浓溶液、布罗利尤单抗、塞奈吉明滴眼液、克立硼罗软膏、阿加糖酶α等。
国产新药在这一年的表现不俗。2020年6月3日,百济神州的首款国产BTK抑制剂泽布替尼在中国正式获批上市;2020年的最后一周,诺诚健华研发的BTK抑制剂奥布替尼也获批上市。在国内,占据主要市场份额的BTK抑制剂是强生的伊布替尼,从2020年开始,国产BTK抑制剂正式加入中国市场的战局。
2020年底,首个国产PARP 抑制剂——恒瑞的氟唑帕利胶囊上市。12月30日获批的索凡替尼,历经十四年研发历程,是全球唯一获批用于治疗非胰腺神经内分泌瘤的VEGFR-TKI药物。此外,国内还迎来了本土企业自主研发的首个抗HER2单抗药物伊尼妥单抗和第一个用于治疗ALK突变晚期非小细胞肺癌的恩沙替尼。作为全球第一款用于结核病诊断、结核杆菌感染诊断的生物制品,智飞生物的重组结核杆菌融合蛋白也值得关注。
2020年NMPA批准的49个新药中,已有包括盐酸可洛、阿美替尼、西尼莫德、泽布替尼等14款通过医保谈判纳入了2020年国家医保目录,且新版医保目录已于3月1日在各地落地执行。。
以国产PD-1单抗为例,公开数据显示,信达生物的信迪利单抗去年3月正式上市,当年上半年实现收入3.32亿元,11月进入医保后价格由7838元/瓶下调至2843元/瓶,随后销量快速提升。信迪利单抗2019年全年实现收入10.16亿元,而2020年上半年销售收入就达到9.21亿元。
2019 年末,泽布替尼在美获批,成为首个国内自主研发获 FDA 批准的创新药;2020 年 6 月,泽布替尼在国内获批,同时获批两项适应症,用于既往至少接受过一种治疗的成人套细胞淋巴瘤患者,以及既往至少接受过一种治疗的成人慢性淋巴细胞白血病/小淋巴细胞淋巴瘤患者。泽布替尼在 2020 年开始贡献营收,根据公司财报,其2020年第四季度中美销售额已达 1835 万美元。
另一进医保的重磅新药—阿美替尼是目前全球第二个获批上市的三代EGFR-TKI药物,用于非小细胞肺癌成人患者。根据弗若斯特沙利文的数据,2018年我国新发非小细胞肺癌患者人数已达到73.7万人,预计2023年将达到85.9万人。
奥西替尼2018年前三季度销售额达12.7亿美元,并且在2018年被纳入了《国家基本医疗保险、工伤保险和生育保险药品目录》乙类范围。阿美替尼未进医保前,价格上相比奥西替尼有很大劣势,不过3月1日新版医保目录执行后,其价格从每年36万元降至3万元,市场情况被看好。
与此同时,药品上市后的准入落地“最后一公里”是促进生物医药产业发展最关键的环节。
“即便是纳入优先审评、附条件审批等“绿色通道”的创新药,仍然需要与其他新上市药品共同参与招标挂网、医保谈判,并不具备时间优势、规则优势。”全国政协委员,苏州大学附属第一医院血液科主任吴德沛认为。
吴德沛建议,国家医保目录从每年一调的“集中受理”模式,转变为随申随谈、限期谈完的“窗口办理”模式,便于新药批准上市后及时申请。企业可以提前准备医保部门所需的相关材料。医保部门可以建立专家库,通过抽签或其他方式确定评估与谈判专家。同时,对于纳入国家医保目录、疗效和价格都有明确优势的新药,尤其是“全球新”的1类新药,应给予绿色进院通道,充分保证患者可及。
上一篇:打破晚期乳腺癌治疗瓶颈!中国首个抗肿瘤新药
下一篇:没有了