
《中国新药与临床杂志》

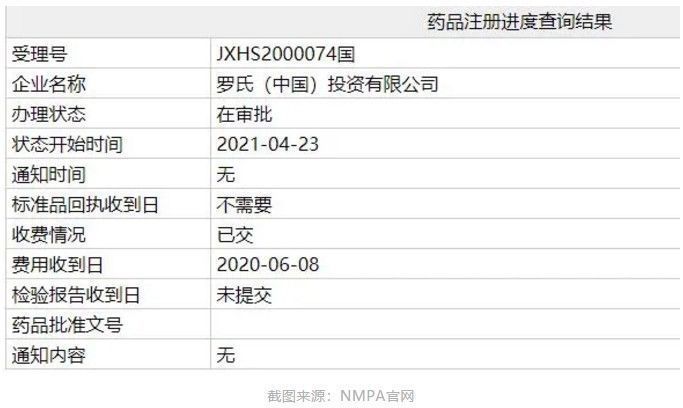
智通财经APP获悉,中国国家药监局(NMPA)药品注册进度查询结果显示,罗氏(RHHBY.US)提交的流感创新药玛巴洛沙韦片(baloxavir marboxil,英文商品名:Xofluza)办理状态已更新为:在审批,这意味着该药有望近期在中国获批。
Xofluza是由日本盐野义制药公司(Shionogi)和罗氏合作研发的一款“first-in-class”的单剂量口服药物。
2018年10月,Xofluza获得FDA批准上市,用于治疗12岁以上无并发症的急性流感患者,成为了近20年以来FDA批准的第一款具有创新作用机制的抗流感新药。2019年10月,FDA再次批准Xofluza的扩大适应症申请,用于治疗12岁及以上流感并发症高风险人群。2020年11月,Xofluza又获得FDA批准用于12岁及以上人群在接触流感患者后的流感预防(称为“暴露后预防”),新闻稿指出这是首个获批用于暴露后预防的单剂量流感药物。
在中国,Xofluza的上市申请于2020年6月获得CDE受理,并被纳入优先审评。2020年11月,该药已被纳入了第三批临床急需境外新药名单。根据优先审评公示信息,Xofluza本次在中国申请的适应症为——用于12周岁及以上的流感患者,包括存在流感并发症高风险的患者。
上一篇:罗氏抗流感新药玛巴洛沙韦片即将国内获批上市
下一篇:没有了