
《中国新药与临床杂志》

一次治疗降低患者出血率91%!Spark血友病A基因疗法长期试验结果积极
罗氏(Roche)旗下的Spark Therapeutics公司,在2020年国际血栓与止血学会(ISTH)虚拟会议上公布了该公司的在研基因疗法SPK-8011,在治疗血友病A的1/2期临床试验中的最新数据。最新数据显示,在12例接受3种不同剂量基因疗法治疗的患者中,随访2-3.3年之后,患者年出血率(ABR)降低91%,凝血因子VIII输注量降低96%,患者的凝血因子VIII表达稳定持久。这一在研疗法的3期临床试验预计在2021年开始。
斩获FDA快速通道资格!辉瑞/BioNTech新冠疫苗2b/3期临床试验有望7月展开
辉瑞(Pfizer)公司和BioNTech公司联合宣布,双方联合开发的4款候选新冠疫苗中,BNT162b1和BNT162b2这两款候选疫苗获得美国FDA授予的快速通道资格。这两款在研疫苗目前正在美国和德国进行的1/2期临床试验中接受评估,是两家公司新冠疫苗研发项目中进展最快的两款候选疫苗。 BNT162研发项目正在评估至少四种候选疫苗,每种疫苗代表着不同mRNA形式和靶抗原的独特组合。BNT162b1和BNT162b2都是核苷修饰的mRNA,通过脂质纳米颗粒(LNP)递送。BNT162b1编码新冠病毒刺突蛋白的受体结合域(RBD)抗原,而BNT162b2编码新冠病毒全长刺突蛋白抗原。辉瑞和BioNTech计划在本月晚些时候启动全球性大规模2b/3期临床试验,预计将注册高达3万名参与者,如果候选疫苗能够获得监管批准,预计在2020年底之前,两家公司能够生产1亿剂疫苗。
BNT162研发项目正在评估至少四种候选疫苗,每种疫苗代表着不同mRNA形式和靶抗原的独特组合。BNT162b1和BNT162b2都是核苷修饰的mRNA,通过脂质纳米颗粒(LNP)递送。BNT162b1编码新冠病毒刺突蛋白的受体结合域(RBD)抗原,而BNT162b2编码新冠病毒全长刺突蛋白抗原。辉瑞和BioNTech计划在本月晚些时候启动全球性大规模2b/3期临床试验,预计将注册高达3万名参与者,如果候选疫苗能够获得监管批准,预计在2020年底之前,两家公司能够生产1亿剂疫苗。12:0!葛兰素史克BCMA抗体偶联药物获咨询委员会投票支持
葛兰素史克(GSK)公司宣布,美国食品药品监督管理局(FDA)肿瘤学药物咨询委员会(ODAC)以12-0的投票结果支持该公司开发的靶向B细胞成熟抗原(BCMA)的抗体偶联药物belantamab mafodotin,在治疗复发/难治性多发性骨髓瘤患者时,获益超过风险。这些患者至少接受过4种既往治疗,包括一种免疫调节剂、一种蛋白酶体抑制剂和一种抗CD38抗体。两名委员会成员不能参加最后表决。此前,belantamab mafodotin的生物制品许可申请(BLA)已经获得美国FDA授予的优先审评资格。如果获批,它可能成为首款治疗这些患者的抗BCMA疗法。Belantamab mafodotin是GSK公司的重点研发项目之一。它将人源化抗BCMA抗体与细胞毒性剂连接在一起。通过靶向BCMA将细胞毒性剂特异性送入MM细胞中起到杀伤癌细胞的作用。BCMA是近年来非常热门的靶点之一,它是一种跨膜糖蛋白,属于肿瘤坏死因子(TNF)受体超家族,又被称为TNFRSF17或CD269。这一蛋白的重要特点是它在所有MM细胞上高度表达,而且它不在其它正常组织中表达(除了浆细胞)。因此,这一靶点成为多家医药公司和研究机构开发治疗复发/难治性MM患者的热门靶点。此前,belantamab mafodotin曾获得美国FDA授予的突破性疗法认定。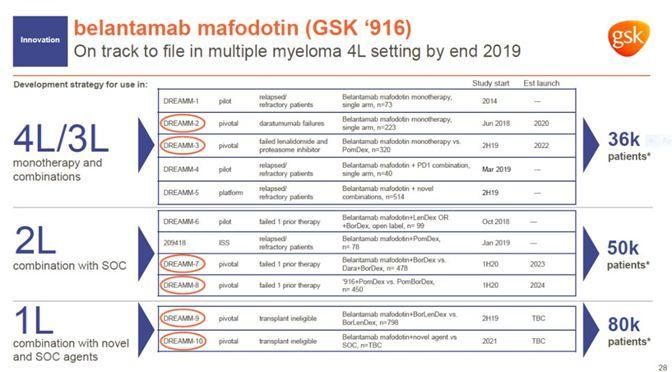
17亿美元大合作!罗氏携手Blueprint开发创新RET抑制剂
Blueprint Medicines公司宣布已与罗氏(Roche)和基因泰克(Genentech,罗氏集团成员)达成一项总额超过17.02亿美元的全球合作,共同开发和商业化精准疗法pralsetinib用于治疗RET变异的癌症患者。通过合作,罗氏将获得pralsetinib在大中华区(包括中国大陆、香港、澳门和台湾地区)和美国以外市场的全球独家许可,以及在美国和Blueprint Medicines共同开发和商业化pralsetinib的权利。基石药业拥有pralsetinib在大中华区的独家开发和商业化权利。上一篇:医科院肿瘤医院正开展的一期抗肿瘤药物试验临
下一篇:没有了