
《中国新药与临床杂志》

Q1
基本信息
伊尼妥单抗(赛普汀)由三生制药旗下三生国健开发,于2018年9月按2类新药提交了该药上市申请,并于2018年11月按优先审评范围(一)7款重大专项被纳入了优先审评程序,于2020年6月获NMPA批准上市。

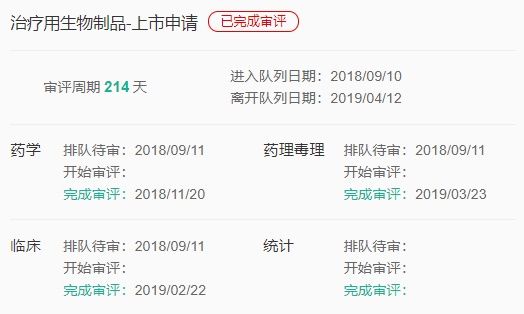
与曲妥珠单抗相比,伊尼妥单抗具有相同的2个Fab段,各214个氨基酸,但是对Fc段进行了氨基酸修饰,同时进行了生产工艺优化。经Fc段修饰后的伊尼妥单抗具有了更强的ADCC(抗体依赖的细胞介导的细胞毒性作用)效应。
Q2
上市背景
乳腺癌是发生在乳腺腺上皮组织的恶性肿瘤,其中约25%的乳腺癌患者表现为HER2阳性。据估计,2018年,中国乳腺癌发病人数大约为32.1万例。目前,国内已上市的抗HER2单抗主要为罗氏的曲妥珠单抗(赫赛汀)、帕妥珠单抗(帕捷特)。2020年1月,罗氏抗体偶联药物恩美曲妥珠单抗(赫赛莱)也在中国获批上市。
弗若斯特沙利文报告显示,2018年,中国抗HER2单抗药物市场大约为32亿元,随着乳腺癌新药的加速上市,更多新药和生物类似药的可及性提高,抗HER2单抗药物市场未来将快速发展,预计在2023年达到约94亿元的市场规模。
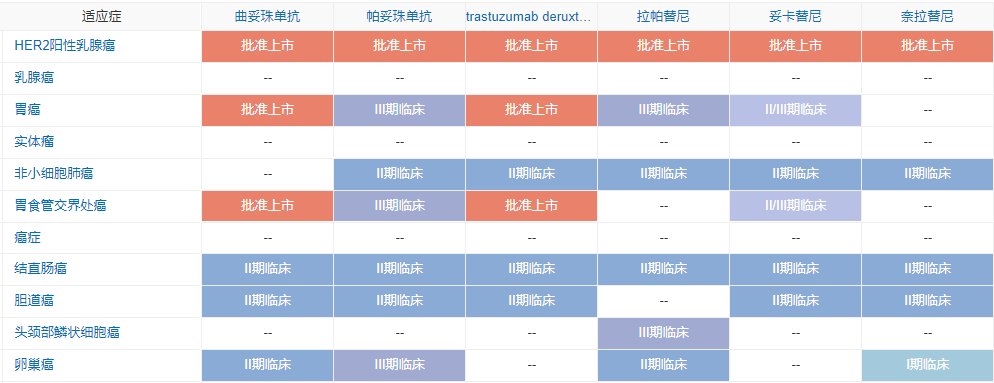
HER2适应症研发布局
Q3
适应症
伊尼妥单抗在中国获批的适应症为HER2阳性的转移性乳腺癌:与长春瑞滨联合治疗已接受过1个或多个化疗方案的转移性乳腺癌患者。
Q4
治疗费用
赛普汀规格为50mg/支,目前中标价为1530元。
12月28日,国家医保局和人力资源社会保障部正式公布了《国家基本医疗保险、工伤保险和生育保险药品目录(2020年)》,赛普汀纳入其中,医保支付标准尚未正式公布,协议期至2022年12月31日。
Q5
循证数据及核心临床
伊尼妥单抗注册临床研究自2009年1月至2013年1月期间共纳入受试者315例(试验组212例,对照组103例),数据显示,伊尼妥单抗联合长春瑞滨治疗既往接受过1个或多个化疗方案的HER2 阳性转移性乳腺癌患者,对比长春瑞滨可显著延长主要终点中位PFS(39.1周vs14.0周,HR=0.24,p<0.0001),使得患者临床获益。
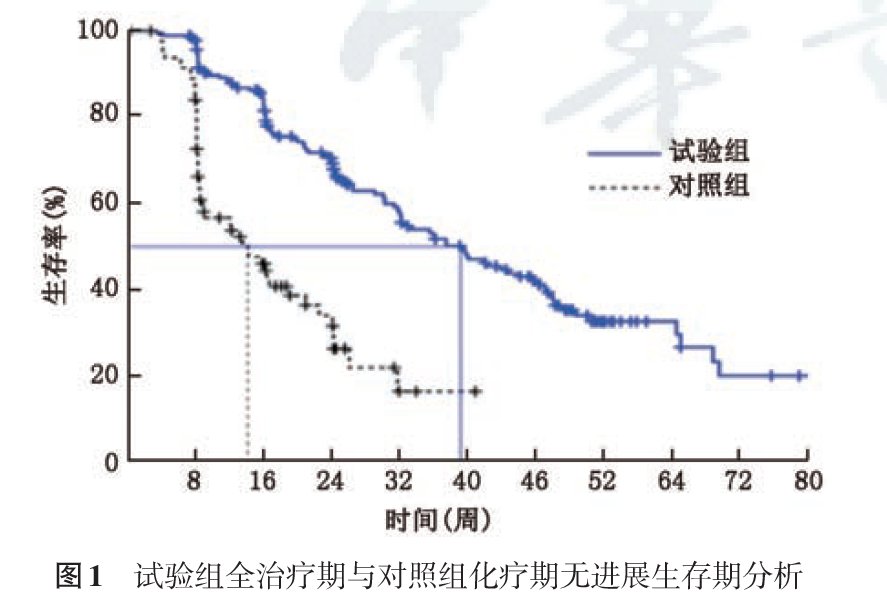
来源:中华医学杂志
试验组客观缓解率(ORR)和疾病控制率(DCR)较对照组均显著提高,ORR为46.7%比18.45%(P<0.0001),DCR为79.72%比45.63%(P<0.0001)。
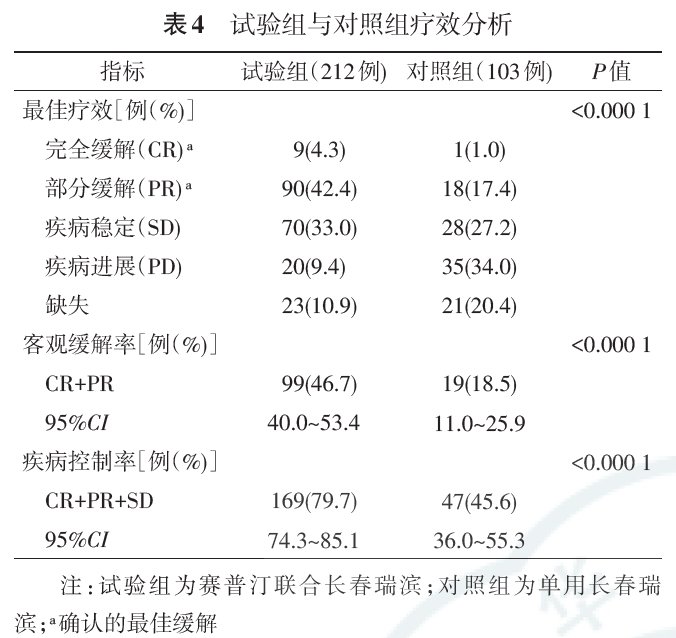
来源:中华医学杂志
安全性方面,中性粒细胞减少、白细胞减少和红细胞减少在两组发生率均较高,但组间差异无统计学意义。与赛普汀相关的不良反应最常见的为输注反应。共5例受试者治疗中心脏左室射血分数降低至低于50%,均可恢复,未出现严重心脏毒性。
Q6
合理用药要点
1. 在接受伊尼妥单抗治疗前,应在有资质的病理实验室进行 HER2 检测,HER2 阳性患者方可应用伊尼妥单抗治疗。
2. 伊尼妥单抗注册临床研究中使用了单周用药方案和三周用药方案。单周用药方案中伊尼妥单抗的推荐初始负荷剂量为4mg/kg,静脉滴注90分钟以上;维持剂量为2mg/kg,每周1次。三周用药方案中伊尼妥单抗的推荐初始负荷剂量为8mg/kg,静脉滴注90分钟以上;维持剂量为6mg/kg,每3周1次。
3. 与蒽环类药物同期应用须慎重,可能增加心脏毒性,严重者会发生心力衰竭,应序贯使用或分别使用。
4. 使用伊尼妥单抗治疗前,应进行病史、体检、心电图、超声心动图LVEF基线评估,使用期间应每 3 个月监测 LVEF。对于发生无症状心功能不全的患者,应频繁监测(如每6~8周一次)。
5. 不推荐合并有以下疾病的患者使用本品:(1)充血性心力衰竭。(2)高危、未控制心律失常。(3)需要药物治疗的心绞痛。(4)有临床意义的心瓣膜疾病。(5)心电图提示透壁性心肌梗死。(6)控制不佳的高血压。
6. 使用伊尼妥单抗发生呼吸困难或者临床显著的低血压时应中断输注,同时给予相应药物治疗,包括肾上腺素、糖皮质激素、苯海拉明、支气管扩张剂和氧气等。发生严重和危及生命的输注相关反应的患者应永久停止使用。
*声明:本文由入驻新浪医药新闻作者撰写,观点仅代表作者本人,不代表新浪医药新闻立场。上一篇:昭衍新药赴港二次上市遇破发,截至收盘市值为
下一篇:没有了