
《中国新药与临床杂志》

★
新闻
★
由南开大学化学学院陈越教授历时11年研发的原药候选药物ACT001正在中国、澳大利亚和美国进行临床试验。 的适应症包括恶性胶质瘤。世界医学问题。
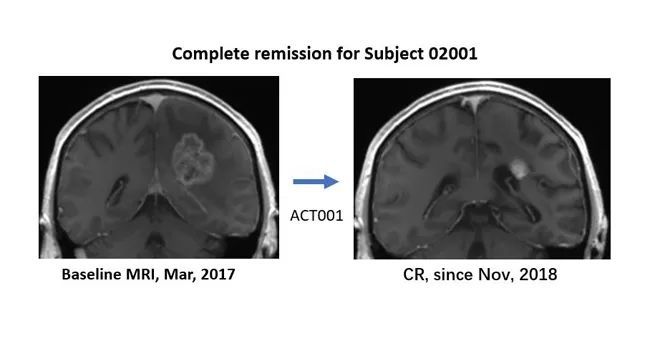
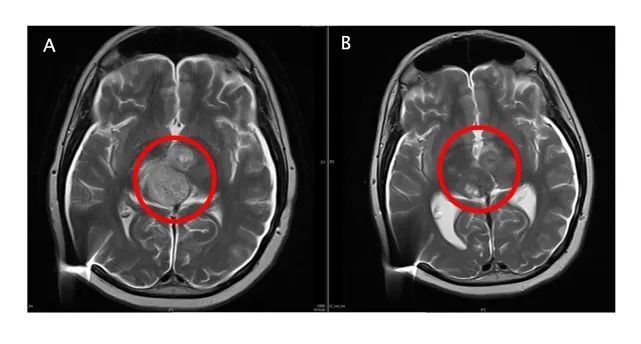
日前,多位主持试验的中外医生公布了ACT001的部分临床试验结果:初步证明了候选新药物是安全有效的。 1例复发性胶质母细胞瘤(GBM)单药治疗50个月以上,完全缓解27个月以上。
ACT001是陈越教授课题组研制的新型结构小分子化合物。其制备原料为小白菊内酯,最早从西方国家传统草药小白菊中提取。小白菊内酯对癌症干细胞有选择性杀伤作用,但其在孤雌生殖中的含量极低。陈越的研究团队进行了大量探索,最终发现我国特有植物信义(山玉兰)根皮中小白菊内酯含量高达9.6%,实际提取率稳定在5%到 6%。该团队通过半合成方法改进了小白菊内酯的化学结构,获得了DMAMCL(即ACT001)。这种小分子化合物口服后可进入血液,突破血脑屏障,直接作用于脑肿瘤病灶。
ACT001拥有完全自主知识产权。已在20多个国家获得专利授权,并于2017年获得美国食品药品监督管理局和欧洲食品药品监督管理局的“孤儿药”认证,在澳大利亚、中国、美国先后有6项是2期或1b/2a临床试验,2项是儿童肿瘤的1期临床试验。适应症包括:胶质母细胞瘤、儿童弥漫性内源性脑桥胶质瘤、癌症脑转移、视神经脊髓炎和肺纤维化。
在今年6月举行的ASCO学术会议上,澳大利亚Nucleus Network医院的Jason Lickliter教授和天津的王平教授肿瘤医院出示了一张海报,表格分别介绍了ACT001治疗复发性胶质母细胞瘤(GBM)的临床试验结果。
胶质母细胞瘤 (GBM) 被世界卫生组织 (WHO) 评为 IV 级。它是一种恶性程度高、复发率高的颅内胶质瘤。中位生存时间小于2年,长期生存率约4%。目前治疗GBM的标准药物是替莫唑胺,但只能延长患者的中位生存时间2.5个月。在成人复发性 GBM 中,Lickliter 教授报告了免疫调节剂 ACT001 的优异安全性和长期存活病例:2017 年 3 月,一名澳大利亚复发性 GBM 患者加入了澳大利亚临床试验。入组时,颅内肿瘤大小接近4厘米。经过ACT001单药长期治疗,于2018年10月达到完全缓解。截至目前,患者已服药50多个月,仍处于完全缓解状态。 Lickliter教授介绍,ACT001联合PD-1免疫疗法治疗复发性GBM的临床试验也在进行中。
上一篇:狂犬病单抗新药临床试验技术指导原则征求意见
下一篇:没有了